Reklamy
Artykuł
Leszek Rudzki, Monika Frank, Agata Szulc, Mirosława Gałęcka, Patrycja Szachta, Dominika Barwinek
Od jelit do depresji - rola zaburzeń ciągłości bariery jelitowej i następcza aktywacja układu immunologicznego w zapalnej hipotezie depresji
Wstęp
Według Światowej Organizacji Zdrowia (World Health Organization - WHO) do 2020 r. depresja stanie się drugą co do częstości występowania chorobą na świecie, ze średnią częstością w ciągu życia sięgającą 15%. W ostatnich 20 latach pojawiła się ogromna liczba dowodów wskazujących na zapalne podłoże depresji. Jej występowanie wykazuje ścisły związek z wieloma chorobami somatycznymi i przewlekłymi. Istnieje wiele analogii pomiędzy objawami depresji a fizjologiczną reakcją organizmu towarzyszącą infekcji i zapaleniu. Obserwacje te sugerują, że depresja może być postrzegana jako zaburzenie psychoneuroimmunologiczne, w którym kluczową rolę odgrywają cytokiny wpływające na funkcje neurochemiczne i neuroendokrynne.
Depresji towarzyszy ogólnoustrojowa reakcja zapalna, za czym przemawiają zwiększone stężenia cytokin prozapalnych: interleukiny (IL)-1beta, IL-5, IL-6 i czynnika martwicy nowotworu alfa (tumor necrosis factor alfa - TNF-alfa), zwiększone stężenia osoczowych pozytywnych białek ostrej fazy, np. haptoglobiny, i zmniejszone stężenia negatywnych białek ostrej fazy, takich jak albuminy czy transferyna (Maes 1993, 1995; Song i wsp. 1994; Myint i wsp. 2005; Elomaa i wsp. 2012). Współzależność aktywacji układu immunologicznego w depresji jest dodatkowo poparta częstym współwystępowaniem depresji z chorobami zapalnymi, takimi jak stwardnienie rozsiane, choroba wieńcowa, infekcja HIV, choroby zapalne jelit i choroby reumatyczne. Pojawia się coraz więcej doniesień dotyczących roli przewodu pokarmowego, zaburzenia ciągłości bariery jelitowej z następczą aktywacją odpowiedzi zapalnej w rozwoju wielu przewlekłych schorzeń, np. zapalnych chorobach jelit, cukrzycy typu 1, alergii, astmy, zaburzeń psychicznych, m.in. autyzmu i depresji (Liu i wsp. 2005). Dlatego też wyjaśnienie zależności pomiędzy depresją, aktywacją układu immunologicznego i zaburzeniami ciągłości bariery jelitowej jest niezwykle istotne w całościowym zrozumieniu tej choroby.
Jelita w zapalnej hipotezie depresji
Jelita - ogromna powierzchnia i niezwykła funkcja
Niezwykle istotny wpływ prawidłowego funkcjonowania jelit na organizm człowieka związany jest m.in. z wielkością omawianego narządu - błona śluzowa jelit ma bowiem największą powierzchnię w ludzkim organizmie, wynoszącą ok. 600 m2. W jelicie cienkim dochodzi do ostatecznego trawienia spożytego pokarmu oraz wchłaniania składników pokarmowych do krwi lub limfy. Długość jelita cienkiego to ok. 280 cm, na jednym milimetrze powierzchni jelita znajduje się ok. 20-40 kosmków pokrytych nabłonkiem walcowatym zaopatrzonym w naczynia krwionośne włosowate i naczynia chłonne. Zewnętrzne ściany kosmków są wyścielone przez mikrokosmki, w wyniku czego powierzchnia jelita kontaktująca się z treścią pokarmową jest ok. 600-krotnie powiększona w stosunku do jego długości i średnicy, osiąga ok. 200-400 m2. Natomiast jelito grube stanowi miejsce ostatecznego wchłaniania wody. Z uwagi na korzystne warunki pH ta część jelita stanowi swoistą "niszę mikrobiologiczną" ludzkiego organizmu.
Jelitowa flora bakteryjna - mikrobiota
Obecność owych symbiontów jest niezbędna do prawidłowego funkcjonowania nie tylko przewodu pokarmowego, lecz także całego ustroju. Jedną z pełnionych przez mikrobiota funkcji jest rozkład składników pokarmowych niepodlegających trawieniu w jelicie cienkim (Gawęcki i Libudzisz 2006). Do wstępnego zasiedlenia jelit przez wybrane mikroorganizmy dochodzi w pierwszym roku życia dziecka, lecz proces ten rozpoczyna się już w momencie porodu (Dibaise i wsp. 2008; Palmer i wsp. 2007; Berg 1996).
Unikatowy i charakterystyczny dla osoby dorosłej skład mikrobiota jest wynikiem działania szeregu czynników egzogennych i endogennych, takich jak oddziaływanie samych mikroorganizmów, zmiany zachodzące w środowisku jelit, zmiany diety z dziecięcej na dietę dorosłych, tryb życia i inne (DiBaise i wsp. 2008; Mackie i wsp. 1999).
Funkcje pełnione przez florę autochtoniczną można podzielić na metaboliczne, troficzne i ochronne. Do funkcji metabolicznych zalicza się: rozkład i fermentację niestrawionych resztek pokarmowych, rozkład toksyn i karcynogenów, produkcję witamin z grupy B i witaminy K, a także wytwarzanie i magazynowanie energii w formie krótkołańcuchowych kwasów tłuszczowych (short-chain fatty acid - SCFA), wykorzystywanych przez organizm m.in. do obniżenia pH jelitowego, wzrostu i różnicowania enterocytów oraz komórek nabłonka jelita grubego. Ponadto wpływają na gospodarkę mineralną, pobudzając absorpcję z jelita grubego jonów wapnia, żelaza i magnezu (DiBaise i wsp. 2008; Macfarlane iMacfarlane 1997; Hooper i wsp. 2002; Roberfroid i wsp. 1995). Mikrobiota syntetyzują także inne substancje odżywiające komórki nabłonka jelitowego, takie jak np. poliaminy. Z kolei do funkcji troficznych należą kontrola ciągłości nabłonka jelitowego poprzez branie udziału w dojrzewaniu i wymianie enterocytów, kontrola czynności motorycznej przewodu pokarmowego i zapewnienie homeostazy systemu immunologicznego (DiBaise i wsp. 2008; Ouwehand i wsp. 2002; Stappenbeck i wsp. 2002; Bäckhed i wsp. 2005).
Prawidłowy skład mikroflory jelit warunkuje także sprawne funkcjonowanie układu immunologicznego. Bytujące w jelitach drobnoustroje są istotnym czynnikiem utrzymania homeostazy układu immunologicznego przewodu pokarmowego (gut-associated lymphoid tissue - GALT). Bakterie jelitowe to jedne z pierwszych antygenów, z którymi układ ten ma kontakt. Można więc zaryzykować stwierdzenie, że komórki im munologiczne w jelicie niejako "trenują" swoją aktywność na mikroflorze autochtonicznej.
Według "higienicznej hipotezy depresji" wzrost zachorowań na depresję, choroby alergiczne i niektóre choroby autoimmunologiczne może być związany z zaburzoną immunoregulacją. Może być ona następstwem ograniczonej ekspozycji na niektóre mikroorganizmy i pasożyty, które prawidłowo stymulują dojrzewanie ludzkiego układu immunologicznego, np. komórek dendrytycznych biorących udział m.in. w supresji odpowiedzi zapalnej. Do aktywności ochronnych mikrobiota należy zapobieganie nadmiernemu rozwojowi mikroorganizmów allochtonicznych (egzogennych), takich jak patogenne serotypy Escherichia coli, bakterie z rodzaju Clostridium, Salmonella czy Shigella, co jest osiągane przede wszystkim na drodze wydzielania związków o aktywności antybakteryjnej.
Jelita, cytokiny a depresja
Wszelkie procesy zachodzące w obrębie jelit, prowadzące do aktywacji układu immunologicznego, są mediowane za pomocą cytokin. W kontekście zapalnej hipotezy depresji cytokiny są głównymi mediatorami wpływającymi na funkcje neurochemiczne i neuroendokrynne. Z tego względu ich aktywacja, związana z zaburzeniem ciągłości bariery jelitowej, stanowi niezwykle istotny mechanizm w rozwoju depresji.
Już w latach 50. w badaniach na modelu zwierzęcym wykazano, że u myszy, u których wywoływano
infekcję, następowały wyraźne zmiany w zachowaniu, m.in. utrata apetytu, wzmożona senność, zmniejszona aktywność ruchowa, zmniejszenie kontaktów z innymi zwierzętami, zmniejszenie aktywności seksualnej, czyli zmiany występujące także u ludzi podczas depresji, które w późniejszym czasie określono jako tzw. sickness behavior. Po transfuzji osocza u myszy zdrowych dochodziło do rozwoju podobnych zmian w zachowaniu. Nieznany jeszcze wtedy czynnik, który wywoływał te
zmiany, określany był mianem "czynnika X". W latach 70. wykazano, że za te zmiany odpowiedzialna jest grupa białek produkowanych przez układ immunologiczny, które od 1979 r. zaczęto określać cytokinami. W późniejszym okresie dowiedziono, że podanie myszom IL-1beta, IL-6, interferonu alfa (IFN-alfa) i TNF-alfa powoduje rozwój tzw. sickness behavior (Kent i wsp. 1992).
Cytokiny są cząsteczkami białkowymi wpływającymi na wzrost, proliferację oraz aktywację komórek układu immunologicznego i komórek hematopoetycznych. Pełnią one funkcję sygnalizacyjną pomiędzy komórkami układu immunologicznego oraz mogą wywierać działania podobne do hormonów i czynników wzrostu.
Cytokiny wykorzystuje się w leczeniu wielu schorzeń, np. wirusowego zapalenia wątroby (WZW) typu B, chorób nowotworowych, AIDS (Wichers iMaes 2002). Już od początku prowadzenia tego typu terapii zaobserwowano jej wyraźny wpływ na funkcje psychiczne (Maes 1995). Działania niepożądane towarzyszące terapii cytokinami, takie jak: obniżenie nastroju, objawy depresyjne występujące u 20-70% pacjentów poddanych terapii IFN-alfa, zmęczenie, zaburzenie rytmów dobowych, nerwowość, utrata apetytu i spadek wagi, zasugerowały istnienie zależności pomiędzy depresją a aktywacją układu immunologicznego.
Cytokiny mogą wywierać wpływ na ośrodkowy układ nerwowy (OUN) kilkoma drogami:
- Przechodząc przez przepuszczające rejony w obrębie bariery krew-mózg,
- Za pomocą aktywnego transportu przez specyficzne dla cytokin mechanizmy transportowe,
- Przez aktywację aferentnych włókien nerwowych, np. nerwu błędnego, które przesyłają bodźce do odpowiednich rejonów mózgu, np. jądra pasma samotnego (Irwin i Miller 2007).
Zaburzenie ciągłości bariery jelitowej
Jednym z czynników prowadzących do uogólnionej reakcji zapalnej jest zwiększona przepuszczalność jelita, czyli tzw. zespół jelita przesiąkliwego (leaky gut syndrome) (Maes i wsp. 2008; Drisko i wsp. 2006). Mechanizmy związane z przeciekającym jelitem to osłabienie ścisłych połączeń (tzw. tight junctions) pomiędzy enterocytami, zaburzenia w obrębie flory jelitowej i uszkodzenia enterocytów. Prowadzą one do dysfunkcji bariery jelitowej i do translokacji do krwi Gram-ujemnych bakterii oraz do reakcji immunologicznej przeciw ich lipo polisacharydom (LPS). Maes i wsp. (2008) pierwsi potwierdzili bezpośrednią zależność pomiędzy zespołem jelita przesiąkliwego a depresją. Wykazali, że u pacjentów z depresją występuje znamiennie zwiększone stężenie immunoglobulin (Ig) M i A przeciwko lipopolisacharydom Gram-ujemnych enterobakterii, które prawidłowo występują w świetle jelit, co wskazuje na to, że depresji towarzyszy zwiększona przepuszczalność ścian jelita i immunologiczna odpowiedź przeciwko tym antygenom.
W związku ze zwiększoną przepuszczalnością bariery jelitowej może także dochodzić do przenikania niestrawionych lub nie w pełni strawionych składników pokarmowych, co powoduje aktywację układu immunologicznego, która jest tożsama z fizjologiczną reakcją układu odpornościowego na szkodliwe patogeny (Drisko i wsp. 2006; Crowe i Perdue 1992; Barau i Dupont 1990). Pokarm, który dotychczas był w pełni tolerowany, staje się antygenem, co może prowadzić do powstawania kompleksów antygen - przeciwciało i do rozwoju alergii pokarmowej typu III, zależnej od IgG. Powstałe kompleksy immunologiczne aktywują układ dopełniacza, powodując migrację fagocytów niszczących kompleks immunologiczny. Mogą one aktywować układ immunologiczny w miejscu ich tworzenia lub przemieszczać się wraz z krążeniem i osadzać się np. w splocie naczyniówkowego OUN, w ścianach naczyń krwionośnych, w błonie maziowej stawów, błonie podstawnej kłębuszków nerkowych (Kuby 1997). Jednocześnie uwalniane są cytokiny prozapalne (IL-1, IL-6, TNF-alfa), a także duże ilości wolnych rodników i proteazy. Przewlekła kumulacja kompleksów immunologicznych w tkankach i organach powoduje miejscowe stany zapalne, niszczenie tkanki objętej procesem zapalnym i może być odpowiedzialna za rozwój chronicznych dolegliwości.
Manifestację alergii IgG-zależnej wykazano m.in. u pacjentów z zespołem jelita drażliwego, u których po 12 tygodniach diety eliminacyjnej pokarmów, na które wystąpiła alergia IgG-zależna, uzyskano zmniejszenie objawów gastroenterologicznych, poprawę parametrów jakości życia oraz zmniejszenie nasilenia objawów lękowych i depresyjnych (Atkinson i wsp. 2004). Z kolei u pacjentów z chorobą afektywną dwubiegunową typu pierwszego wykazano istotnie podwyższony poziom przeciwciał IgG przeciw kazeinie w stosunku do grupy kontrolnej. Poziom przeciwciał IgG korelował z nasileniem objawów manii, historią objawów psychotycznych, ale nie depresji (Severance i wsp. 2010).
Zaburzenie funkcji bariery jelitowej okazuje się także niezwykle istotne w autyzmie. Badania wskazują na istnienie zwiększonej przepuszczalności jelit u pacjentów autystycznych w porównaniu z grupą kontrolną (D?Eufemia i wsp. 1996). U części pacjentów dieta bezglutenowa i bezkazeinowa powoduje zmniejszenie objawów autyzmu (Knivsberg i wsp. 2002). Shattock i Whiteley (2002) sformułowali hipotezę, że rozwój autyzmu może być związany z wpływem peptydów opioidowych pochodzenia pokarmowego - gliadomorfiny i kazomorfiny, które określono mianem egzorfin. Substancje te, powstające na skutek nieprawidłowego trawienia glutenu i kazeiny, przechodząc przez zaburzoną barierę jelitową, mogą wywierać niekorzystny wpływ na OUN.
Do czynników negatywnie wpływających na funkcjonowanie i selektywność bariery jelitowej zalicza się przede wszystkim: zwiększone stężenia IL-1beta, IL-6, TNF-alfa i IFN-gamma (Clark i wsp. 2005; Chavez i wsp. 1999; Yang i wsp. 2003; Al-Sadi iMa 2007; Ye i wsp. 2006), następnie NFkappaB (Al-Sadi iMa 2007), podwyższoną produkcję wolnych rodników tlenowych (reactive oxygen species - ROS) (Sun i wsp. 2002), tlenku azotu (NO) (Viljoen i wsp. 2003), zmniejszone stężenie antyoksydantów (np. glutaminy) (Wu i wsp. 2004), zakażenia wirusowe, bakteryjne i pasożytnicze, grzybice przewodu pokarmowego (kandydozy), oddziaływanie toksyn środowiska zewnętrznego (np. metali ciężkich), nadużywanie alkoholu i leków (zwłaszcza niesteroidowych leków przeciwzapalnych), przyjmowane z pokarmem konserwanty i barwniki żywnościowe czy niedożywienie jakościowe oraz stres. Wykazano zwiększoną przepuszczalność bariery jelitowej pod wpływem stresu przewlekłego i nagłego, zarówno psychicznego, jak i fizycznego, u ludzi i na modelu zwierzęcym (Hart i Kamm 2002). Zmiany te związane są ze zwiększonym wydzielaniem kortykoliberyny (corticotropin-releasing hormone - CRH) pod wpływem stresu przez miejscowo działające komórki immunologiczne, neurony współczulne i jelitowe komórki enterochromafinowe (Santos i wsp. 1999). Ponadto wykazano na modelu zwierzęcym, że pod wpływem stresu dochodzi do degranulacji komórek tucznych, która może nawet zachodzić na zasadzie warunkowania klasycznego Pawłowa (Santos i wsp. 2001).
Mechanizmy wpływu cytokin na ośrodkowy układ nerwowy w depresji
Cytokiny i neurotransmisja serotoninergiczna
Wykazano, że IFN-gamma, TNF-alfa i IL-1 powodują aktywację transporterów serotoniny, co prowadzi do zmniejszenia jej stężenia w przestrzeni zewnątrz komórkowej (Morikawa iwsp. 1998). Interferon alfa moduluje także funkcjonowanie receptorów 5-HT1A oraz 5-HT2 (Abe i wsp. 1999). Inną drogą, którą cytokiny oddziałują na stężenie serotoniny, jest wpływ na metabolizm enzymów szlaku kinureninowego, w którym metabolizowany jest tryptofan, prekursor serotoniny. Interferon alfa, IFN-beta, TNF-alfa i IFN-gamma podwyższają aktywność 2,3-dioksygenazy indoleaminy, enzymu biorącego udział w przemianie tryptofanu w kinureninę, kwas chinolinowy, 3-hydroksy-kinureninę, tym samym przesuwając tryptofan ze szlaku produkcji serotoniny, zmniejszając jej stężenie i zwiększając stężenie niekorzystnie działających na OUN metabolitów tryptofanu (Wichers i Maes 2004; Maes i wsp. 2011).
Ryc. 1. Potencjalna zależność pomiędzy dysfunkcją bariery jelitowej (leaky gut syndrome), aktywacją zapalnej odpowiedzi immunologicznej, rozwojem alergii pokarmowej IgG-zależnej (nadwrażliwością typu III) oraz depresją
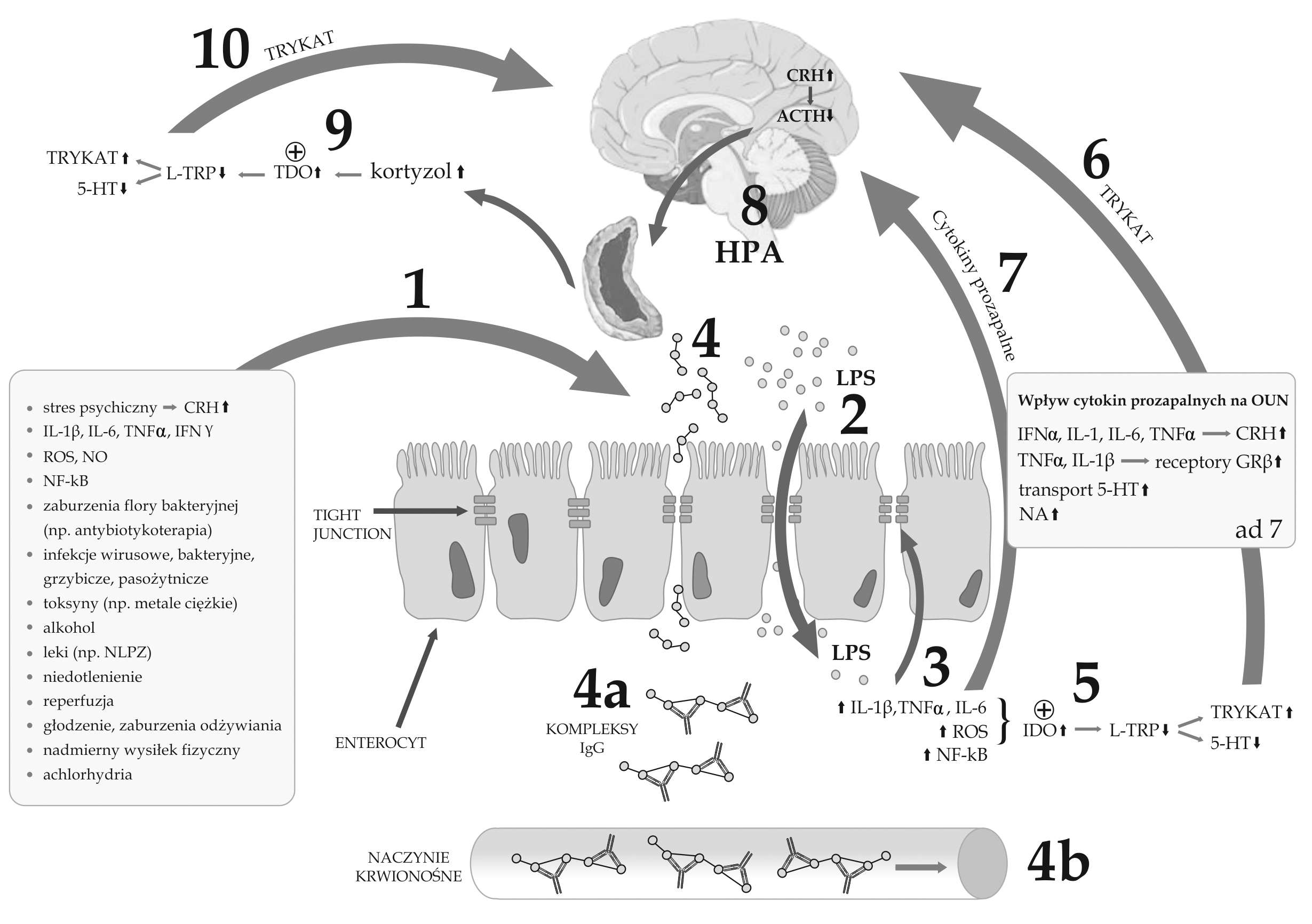
1 - czynniki powodujące dysfunkcję bariery jelitowej, zwiększenie jej przepuszczalności (leaky gut syndrome) oraz osłabienie ścisłych połączeń (tight junctions - TJ);
2 - zwiększona translokacja bakterii znajdujących się w świetle jelita w następstwie osłabionej ciągłości bariery jelitowej oraz aktywacja układu immunologicznego poprzez lipopolisacharydy (LPS) bakteryjne, aktywacja stanu zapalnego ze zwiększonym stężeniem prozapalnych cytokin, nasileniem stresu oksydacyjnego, aktywacją NF-kappaB - czynnika transkrypcji jądrowej;
3 - dalsze osłabianie bariery jelitowej i uszkodzenie TJ pod wpływem zwiększonego stężenia cytokin prozapalnych, nasilonego stresu oksydacyjnego i nitrozacyjnego (ROS, NO), aktywacji NF-kappaB;
4 - przenikanie niestrawionych lub nie w pełni strawionych składników pokarmowych przez osłabioną barierę jelitową;
4a - spłaszczanie antygenów pokarmowych przez przeciwciała IgG z powstaniem kompleksów antygen-przeciwciało w miejscu wnikania antygenów;
4b - powstawanie kompleksów IgG antygen-przeciwciało w naczyniach krwionośnych i ich przemieszczenie się wraz z krążeniem i osadzanie się np. w splocie naczyniówkowym OUN, w ścianach naczyń krwionośnych, w błonie maziowej stawów, błonie podstawnej kłębuszków nerkowych; przewlekła kumulacja kompleksów immunologicznych i indukcja stanu zapalnego może powodować rozwój chronicznych dolegliwości;
5 - aktywacja2,3-dioksygenazy indoleaminy (IDO) przez cytokiny prozapalne i stres oksydacyjny z następczym zmniejszeniem stężenia tryptofanu i serotoniny(5-HT) oraz zwiększeniem stężeń katabolitów tryptofanu (TRYKAT);
6 - szkodliwy wpływ katabolitów tryptofanu na OUN;
7 - wpływ cytokin prozapalnych na OUN poprzez zwiększenie stężenia CRH i aktywację osi podwzgórzowo-przysadkowo-nadnerczowej (HPA); zwiększenie ekspresji nieaktywnej formy receptora glikokortykoidów GRbeta w stosunku do formy aktywnej GRalfa i rozwój oporności na glikokortykoidy; aktywacja transporterów serotoniny i zmniejszenie jej stężenia w przestrzeni zewnątrzkomórkowej; nasilenie neurotransmisji noradrenergicznej pod wpływem cytokin;
8 - aktywacja osi HPA i następcze zwiększenie stężenia kortyzolu;
9 - aktywacja 2,3-dioksygenazy tryptofanu (TDO) przez zwiększone stężenie kortyzolu z następczym zmniejszeniem stężenia tryptofanu i serotoniny (5-HT) oraz zwiększeniem stężeń katabolitów tryptofanu (TRYKAT);
10 - szkodliwy wpływ katabolitów tryptofanu na OUN.
Ze względu na bardzo szeroką dystrybucję IDO w organizmie stany zapalne w różnych organach mogą wpływać na metabolizm tryptofanu. 2,3-dioksygenaza tryptofanu (TDO) jest kolejnym enzymem szlaku kinureninowego biorącym udział w metabolizmie tryptofanu, występującym w wątrobie i mózgu (Miller i wsp. 2006). Zwiększone stężenie glikokortykoidów aktywuje wątrobowe TDO, prowadząc do zmniejszenia stężenia tryptofanu i podwyższenia jego toksycznych metabolitów. Badania post mortem pacjentów ze schizofrenią wykazały zwiększone stężenie TDO w korze czołowej, co sugeruje potencjalną rolę metabolitów szlaku kinureninowego w patogenezie schizofrenii, psychoz i przypuszczalnie innych zaburzeń psychicznych (Miller i wsp. 2004).
Kinurenina jest przekształcana dwoma szlakami metabolicznymi, które prowadzą do powstania 3-hydroksy-kinureniny i kwasu chinolinowego lub kwasu kinureninowego. 3-hydroksykinurenina zwiększa stres oksydacyjny działający na OUN, zwiększając produkcję ROS, przyczyniając się do apoptozy neuronów i zaburzania funkcji receptorów serotoninergicznych i noradrenergicznych (Moroni 1999; Van der Vliet i wsp. 1992). Kwas chinolinowy jest natomiast silnym agonistą receptorów NMDA (N-metylo-D-asparaginian) (Schwarcz i wsp. 1983), wykazuje działanie neuroekscytacyjne i eurotoksyczne, powoduje zwiększenie synaptycznego stężenia glutaminianu i obniża poziom mózgowego kwasu gamma-aminobutyrylowego (gamma-aminobutyric acid - GABA) (Vonsattel i wsp. 1985).
Kwas kinureninowy natomiast, ze względu na swój antagonizm do receptorów NMDA, wykazuje działanie neuroprotekcyjne. Cytokiny i neurotransmisja noradrenergiczna Opisano także wpływ cytokin na układ noradrenergiczny. Na modelu zwierzęcym wykazano pobudzające działanie IL-1 na neurotransmisję noradrenergiczną (Kabiersch i wsp. 1988). Zarówno podaż IL-1, jak i IL-2 powoduje podwyższenie stosunku MHPG (3-metoksy-4 hydroksyfenyloglikolu), który jest metabolitem noradrenaliny, do stężenia noradrenaliny, co przemawia za nasiloną neurotransmisją noradrenergiczną pod wpływem cytokin (Dunn i wsp. 1999). Wpływ cytokin na oś podwzgórzowo-przysadkowo-nadnerczową Istnieje wiele dowodów na wpływ cytokin na oś HPA. Interferon alfa, IL-1, IL-6 i TNF-alfa powodują zwiększenie wydzielania CRH. Wykazano istotną korelację pomiędzy podwyższeniem poziomów ACTH i kortyzolu pod wpływem 8-tygodniowej terapii IFN-alfa i jej wpływem na rozwój depresji, lęku oraz zaburzeń funkcji poznawczych (Capuron i wsp. 2003). Cytokiny a receptor glikokortykoidów Czynnik martwicy nowotworu alfa i IL-1beta powodują zwiększenie ekspresji nieaktywnej formy receptora - GRbeta - w stosunku do formy aktywnej - GRalfa, co może powodować oporność na glikokortykoidy, charakterystyczną dla depresji (Webster i wsp. 2001).
Leki przeciwdepresyjne, antyoksydanty a cytokiny
W licznych badaniach z udziałem pacjentów wykazano wpływ leków przeciwdepresyjnych na zmniejszanie stężeń cytokin prozapalnych IL-1beta i IL-6. Leki przeciwdepresyjne z grupy selektywnych inhibitorów zwrotnego wychwytu serotoniny (selective serotonin re-uptake inhibitor - SSRI) zmniejszały stężenia głównie IL-6 i TNF-alfa (Hannestad i wsp. 2011). Kubera i wsp. (2001) zasugerowali, że duża część leków przeciwdepresyjnych zmniejsza stężenie prozapalnego IFN-gamma lub zwiększa stężenie działającej przeciwzapalnie IL-10, tym samym działając przeciwzapalnie.
W badaniach na zwierzętach wykazano, że escitalopram zmniejszał stężenia TNF-alfa i IL-1beta (Bah i wsp. 2011). Niektóre z antyoksydantów mogą wykazywać działanie przeciwdepresyjne, wpływającm.in. na szlaki stresu oksydacyjnego i nitrozacyjnego oraz modyfikując aktywność IDO. Ebselen, substancja naśladująca działanie peroksydazy glutationowej (GPX), jest silnym enzymem antyoksydacyjnym wykazującym działanie przeciwdepresyjne, które jest zależne od wpływu na interakcję z układem serotoninergicznym i dopaminergicznym (Posser i wsp. 2009). Ebselen hamuje także aktywność IDO (Terentis i wsp. 2010).
Podobnie galusan epigallokatechiny (EGCG) - główny składnik zielonej herbaty - oraz kwas rozmarynowy hamują IDO i blokują działanie IFN-gamma (Alkam i wsp. 2007; Cheng i wsp. 2010; Jang i wsp. 2010).
Na szczególną uwagę zasługuje kurkumina, wykorzystywana od kilku tysięcy lat jako substancja o działaniu przeciwdepresyjnym w medycynie chińskiej. Okazuje się ona silnym antyoksydantem i inhibitorem NF-kappaB, czynnika transkrypcji jądrowej, który odgrywa kluczową rolę w regulacji odpowiedzi immunologicznej. Według Rutkowskiego i wsp. (2005) specyficzne białka hamujące działanie NF-kappaB będą w przyszłości wykorzystywane w leczeniu licznych chorób zapalnych. Kurkumina także ogranicza niekorzystny wpływ cytokin na receptory glikokortykoidów (Xu i wsp. 2007) i hamuje aktywność IDO (Zhang i wsp. 2008). Ponadto wykazano istotne gastroprotekcyjne i przeciwdepresyjne działanie kompleksu cynku i kurkuminy (Mei i wsp. 2011).
W ostatnich 10 latach pojawiło się wiele dowodów na przeciwdepresyjne działanie cynku. Wykazano istotnie zmniejszone jego stężenie w depresji oraz odwrotną korelację pomiędzy stężeniem cynku a nasileniem depresji (Maes i wsp. 1994; Nowak i wsp. 2003). Także kobiety cierpiące na depresję około- i poporodową mają zmniejszone stężenie cynku (Wójcik i wsp. 2006). Wykazano także istotną poprawę skuteczności leczenia depresji jednobiegunowej dzięki dodaniu cynku do leków przeciwdepresyjnych (Siwek i wsp. 2009). Co ciekawe, istnieje także zależność pomiędzy poprawą szczelności bariery jelitowej w chorobie Crohna a suplementacją cynkiem (Sturniolo i wsp. 2001).
Podsumowanie
Psychiatria - leczenie chorób psychicznych - staje się coraz bardziej interdyscyplinarną dziedziną. Dzięki szerszemu, bardziej holistycznemu spojrzeniu na pacjenta psychiatrycznego oraz na depresję jako zaburzenie psychoneuroimmunologiczne pojawiają się nowe możliwości terapeutyczne.
Na podstawie powyżej przedstawionych powiązań zapalnej hipotezy depresji, jelit jako "wrót" aktywacji układu immunologicznego, zwiększonej przepuszczalności bariery jelitowej, wpływu cytokin prozapalnych na meta - bolizm tryptofanu i jego metabolitów oraz szeregu mechanizmów oddziaływań cytokin prozapalnych na OUN coraz bardziej zasadne staje się pojęcie tzw. osi czy bariery jelitowo-mózgowej (gut-brain barier) w kontekście patogenezy zaburzeń psychicznych, w tym depresji. Tematyka ta jest niezwykle ciekawa i w ostatnim czasie prężnie się rozwija, dlatego też dalsze badania zależności psycho-neuro-immunologiczno-kinureninowych oraz potencjalnej roli zwiększonej przepuszczalności bariery jelitowej dla LPS bakteryjnych oraz kompleksów immunologicznych IgG z alergenami pokarmowymi wydaje się obiecującym kierunkiem dalszych badań, a starochińskie przysłowie "jeżeli nie znasz ojca choroby, to jej matką jest zła dieta" nabiera nowego znaczenia także w kontekście chorób psychicznych.
- Autorzy: Leszek Rudzki, Agata Szulc pracują w Klinice Psychiatrii Uniwersytetu Medycznego w Białymstoku.
Monika Frank, Mirosława Gałęcka i Patrycja Szachta pracują w Instytucie Mikroekologii w Poznaniu.
Dominika Barwinek pracuje na Wydziale Chemicznym Politechniki Wrocławskiej.
Artykuł opublikowano w czasopiśmie "Neuropsychiatria i Neuropsychologia" 2012; 7, 2: ss. 76-84.
Bibliografia
- Abe S, Hori T, Suzuki T, et al. Effects of chronic administration of interferon alpha A/D on serotonergic receptors in rat brain. Neurochem Res 1999; 24: 359-363.
- Alkam T, Nitta A, Mizoguchi H, et al. A natural scavenger of peroxynitrites, rosmarinic acid, protects against impairment of memory induced by Abeta(25-35). Behav Brain Res 2007; 180: 139-145.
- Al-Sadi RM, Ma TY. IL-1beta causes an increase in intestinal epithelial tight junction permeability. J Immunol 2007; 178: 4641-4649.
- Atkinson W, Sheldon TA, Shaath N, Whorwell PJ. Food elimination on IgG antibodies in irritable bowel syndrome: a randomised controlled trial. Gut 2004; 53: 1459-1464.
- Bäckhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine. Science 2005; 307: 1915-1920.
- Bah TM, Benderdour M, Kaloustian S, et al. Escitalopram reduces circulating pro-inflammatory cytokines and improves depressive behavior without affecting sleep in a rat model of post-cardiac infarct depression. Behav Brain Res 2011; 225: 243-251.
- Barau E, Dupont C. Modifications of intestinal permeability during food provocation procedures in pediatric irritable bowel syndrome. J Pediatr Gastroenterol Nutr 1990; 11: 72-77.
- Berg RD. The indigenous gastrointestinal microflora. Trends Microbiol 1996; 4: 430-435.
- Capuron L, Raison CL, Musselman DL, et al. Association of exaggerated HPA axis response to the initial injection of interferon-alpha with development of depression during interferon-alpha therapy. Am J Psychiatry 2003; 160: 1342-1345.
- Chavez AM, Menconi MJ, Hodin RA, Fink MP. Cytokineinduced intestinal epithelial hyperpermeability: role of nitric oxide. Crit Care Med 1999; 27: 2246-2251.
- Cheng CW, Shieh PC, Lin YC, et al. Indoleamine 2,3-dioxygenase, an immunomodulatory protein, is suppressed by (-)-epigallocatechin-3-gallate via blocking of gamma-interferon- induced JAK-PKC-delta-STAT1 signaling in human oral cancer cells. J Agric Food Chem 2010; 58: 887-894.
- Clark E, Hoare C, Tanianis-Hughes J, et al. Interferon gamma induces translocation of commensal Escherichia coli across gut epithelial cells via a lipid raft-mediated process. Gastroenterology 2005; 128: 1258-1267.
- Crowe SE, Perdue MH. Gastrointestinal food hypersensitivity: basic mechanisms of pathophysiology. Gastroenterology 1992; 103: 1075-1095.
- D'Eufemia P, Celli M, Finocchiaro R, et al. Abnormal intestinal permeability in children with autism. Acta Paediatr 1996; 85: 1076-1079.
- DiBaise JK, Zhang H, Crowell MD, et al. Gut microbiota and its possible relationship with obesity. Mayo Clin Proc 2008; 83: 460-469.
- Drisko J, Bischoff B, Hall M, McCallum R. Treating irritable bowel syndrome with a food elimination diet followed by food challenge and probiotics. J Am Coll Nutr 2006; 25: 514-522.
- Dunn AJ, Wang J, Ando T. Effects of cytokines on cerebral neurotransmission. Comparison with the effects of stress. Adv Exp Med Biol 1999; 461: 117-127.
- Elomaa AP, Niskanen L, Herzig KH, et al. Elevated levels of serum IL-5 are associated with an increased likelihood of major depressive disorder. BMC Psychiatry 2012; 12: 2.
- Gawęcki J, Libudzisz Z. Mikroorganizmy w żywności i żywieniu. Wyd. Akademii Rolniczej im. Augusta Cieszkowskiego, Poznań 2006.
- Hart A, Kamm MA. Review article: mechanisms of initiation and perpetuation of Gut inflammation by stress. Aliment Pharmacol Ther 2002; 16: 2017-2028.
- Hannestad J, DellaGioia N, Bloch M. The effect of antidepressant medication treatment on serum levels of inflammatory cytokines: a meta-analysis. Neuropsychopharmacology 2011; 36: 2452-2459.
- Hooper LV, Midtvedt T, Gordon JI. How host-microbial interactions shape the nutrient environment of the mammalian intestine. Annu Rev Nutr 2002; 22: 283-307.
- Irwin MR, Miller AH. Depressive disorders and immunity: 20 years of progress and discovery. Brain Behav Immun 2007; 21: 374-383.
- Jang S, Jeong HS, Park JS, et al. Neuroprotective effects of epigallocatechin-3-gallate against quinolinic acid-induced excitotoxicity via PI3K pathway and NO inhibition. Brain Res 2010; 1313: 25-33.
- Kabiersch A, del Rey A, Honegger CG, Besedovsky HO. Interleukin-1 induces changes in norepinephrine metabolism in the rat brain. Brain Behav Immun 1988; 2: 267- 274.
- Kent S, Bluthé RM, Kelley KW, Dantzer R. Sickness behavior as a new target for drug development. Trends Pharmacol Sci 1992; 13: 24-28.
- Knivsberg AM, Reichelt KL, Ho/ien T, No/dland M. A randomised, controlled study of dietary intervention in autistic syndromes. Nutr Neurosci 2002; 5: 251-261.
- Kuby J. Immunology. 3rd ed. W.H. Freeman & Co., New York 1997.
- Liu Z, Li N, Neu J. Tight junctions, leaky intestines, and pediatric diseases. Acta Paediatr 2005; 94: 386-393.
- Macfarlane GT, Macfarlane S. Human colonic microbiota: ecology, physiology and metabolic potential of intestinal bacteria. Scand J Gastroenterol Suppl 1997; 222: 3-9.
- Mackie RI, Sghir A, Gaskins HR. Developmental microbial ecology of the neonatal gastrointestinal tract. Am J Clin Nutr 1999; 69: 1035S-1045S.
- Maes M. A review on the acute phase response in major depression. Rev Neurosci 1993; 4: 407-416.
- Maes M, D?Haese PC, Scharpé S, et al. Hypozincemia in depression. J Affect Disord 1994; 31: 135-140.
- Maes M. Evidence for an immune response in major depression: a review and hypothesis. Prog Neuropsychopharmacol
Biol Psychiatry 1995; 19: 11-38. - Maes M, Kubera M, Leunis JC. The gut-brain barrier in major depression: intestinal mucosal dysfunction with an increased translocation of LPS from gram negative enterobacteria (leaky gut) plays a role in the inflammatory pathophysiology of depression. Neuro Endocrinol Lett 2008; 29: 117-124.
- Maes M, Leonard BE, Myint AM, et al. The new ?5-HT? hypothesis of depression: cell-mediated immune activation induces indoleamine 2,3-dioxygenase, which leads to lower plasma tryptophan and an increased synthesis of detrimental tryptophan catabolites (TRYCATs), both of which contribute to the onset of depression. Prog Neuropsychopharmacol Biol Psychiatry 2011; 35: 702-721.
- Mei X, Xu D, Xu S, et al. Gastroprotective and antidepressant effects of a new zinc(II)?curcumin complex in rodent models of gastric ulcer and depression induced by stresses. Pharmacol Biochem Behav 2011; 99: 66-74.
- Miller CL, Llenos IC, Dulay JR, et al. Expression of the kynurenine pathway enzyme tryptophan 2,3-dioxygenase is increased in the frontal cortex of individuals with schizophrenia. Neurobiol Dis 2004; 15: 618-629.
- Miller CL, Llenos IC, Dulay JR, Weis S. Upregulation of the initiating step of the kynurenine pathway in postmortem
anterior cingulate cortex from individuals with schizophrenia and bipolar disorder. Brain Res 2006; 1073-1074: 25-37. - Morikawa O, Sakai N, Obara H, Saito N. Effects of interferon- alpha, interferon-gamma and cAMP on the transcriptional regulation of the serotonin transporter. Eur J Pharmacol 1998; 349: 317-324.
- Moroni F. Tryptophan metabolism and brain function: focus on kynurenine and other indole metabolites. Eur J Pharmacol 1999; 375: 87-100.
- Myint AM, Leonard BE, Steinbusch HW, Kim YK. Th1, Th2, and Th3 cytokine alterations in major depression. J Affect Disord 2005; 88: 167-173.
- Nowak G, Siwek M, Dudek D, et al. Effect of zinc supplementation on antidepressant therapy in unipolar depression:
a preliminary placebo-controlled study. Pol J Pharmacol 2003; 55: 1143-1147. - Ouwehand A, Isolauri E, Salminen S. The role of the intestinal microflora for the development of the immune system
in early childhood. Eur J Nutr 2002; 41 Suppl 1: 132-137. - Palmer C, Bik EM, DiGiulio DB, et al. Development of the human infant intestinal microbiota. PLoS Biol 2007; 5: e177.
- Posser T, Kaster MP, Baraúna SC, et al. Antidepressantlike effect of the organoselenium compound ebselen in mice: evidence for the involvement of the monoaminergic system. Eur J Pharmacol 2009; 602: 85-91.
- Roberfroid MB, Bornet F, Bouley C, Cummings JH. Colonic microflora: nutrition and health: summary and conclusions of an international Life Sciences Institute (ILSI) [Europe] workshop held in Barcelona, Spain. Nutr Rev 1995; 53: 127-130.
- Rutkowski R, Pacewicz S, Skrzydlewska T i wsp. Właściwości biologiczne czynnika transkrypcji jądrowej. Alergia Astma Immunologia 2005; 10: 125-131.
- Santos J, Saunders PR, Hanssen NP, et al. Corticotropinreleasing hormone mimics stress-induced colonic epithelial pathophysiology in the rat. Am J Physiol 1999; 277 (2 Pt 1): G391-399.
- Santos J, Yang PC, Söderholm JD, et al. Role of mast cells in chronic stress induced colonic epithelial barrier dysfunction in the rat. Gut 2001; 48: 630-636.
- Schwarcz R, Whetsell WO Jr, Mangano RM. Quinolinic acid: an endogenous metabolite that produces axon-sparing lesions in rat brain. Science 1983; 219: 316-318.
- Severance EG, Dupont D, Dickerson FB, et al. Immune activation by casein dietary antigens in bipolar disorder. Bipolar Disord 2010; 12: 834-842.
- Siwek M, Dudek D, Paul IA, et al. Zinc supplementation augments efficacy of imipramine in treatment resistant patients: a double blind, placebo controlled study. J Affect Disord 2009; 118: 187-195.
- Song C, Dinan T, Leonard BE. Changes in immunoglobulin, complement and acute chase protein levels in the depressed patients and normal controls. J Affect Disord 1994; 30: 283-288.
- Stappenbeck TS, Hooper LV, Gordon JI. Developmental regulation of intestinal angiogenesis by indigenous microbes via Paneth cells. Proc Natl Acad Sci U S A 2002; 99: 15451-15455.
- Sturniolo GC, Di Leo V, Ferronato A, et al. Zinc supplementation tightens ?leaky gut" in Crohn?s disease. Inflamm Bowel Dis 2001; 7: 94-98.
- Sun Z, Lasson A, Olanders K, et al. Gut barrier permeability, reticuloendothelial system function and protease inhibitor levels following intestinal ischaemia and reperfusion- effects of pretreatment with N-acetyl-L-cysteine and indomethacin. Dig Liver Dis 2002; 34: 560-569.
- Terentis AC, Freewan M, Sempértegui Plaza TS, et al. The selenazal drug ebselen potently inhibits indoleamine 2,3-dioxygenase by targeting enzyme cysteine residues. Biochemistry 2010; 49: 591-600.
- Van der Vliet A, Bast A. Effect of oxidative stress on receptors and signal transmission. Chem Biol Interact 1992; 85: 95-116.
- Viljoen M, Panzer A, Willemse N. Gastro intestinal hyperpermeability: a review. East Afr Med J 2003; 80: 324-330.
- Vonsattel JP, Myers RH, Stevens TJ, et al. Neuropathological classification of Huntington?s disease. J Neuropathol Exp Neurol 1985; 44: 559-577.
- Webster JC, Oakley RH, Jewell CM, Cidlowski JA. Proinflammatory cytokines regulate human glucocorticoid receptor gene expression and lead to the accumulation of the dominant negative beta isoform: a mechanism for the generation of glucocorticoid resistance. Proc Natl Acad Sci U S A 2001; 98: 6865-6870.
- Wichers M, Maes M. The psychoneuroimmuno-pathophysiology of cytokine-induced depression in humans. Int J Neuropsychopharmacol 2002; 5: 375-388.
- Wichers MC, Maes M. The role of indoleamine 2,3-dioxygenase (IDO) in the pathophysiology of interferon-alfa- induced depression. J Psychiatry Neurosci 2004; 29: 11-17.
- Wójcik J, Dudek D, Schlegel-Zawadzka M, et al. Antepartum/ postpartum depressive symptoms and serum zinc and magnesium levels. Pharmacol Rep 2006; 58: 571-576.
- Wu GH, Wang H, Zhang YW, et al. Glutamine supplemented parenteral nutrition prevents intestinal ischemiareperfusion injury in rats. World J Gastroenterol 2004; 10: 2592-2594.
- Xu Y, Ku B, Cui L, et al. Curcumin reverses impaired hippocampal neurogenesis and increases serotonin receptor 1A mRNA and brain-derived neurotrophic factor expression in chronically stressed rats. Brain Res 2007; 1162: 9-18.
- Yang R, Han X, Uchiyama T, et al. IL-6 is essential for development of gut barrier dysfunction after hemorrhagic shock and resuscitation in mice. Am J Physiol Gastrointest Liver Physiol 2003; 285: G621-629.
- Ye D, Ma I, Ma TY. Molecular mechanism of tumor necrosis factor-alpha modulation of intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol 2006; 290: G496-504.
- Zhang KS, Li GC, He YW, et al. Curcumin inhibiting the expression of indoleamine 2,3-dioxygenase induced by IFNgamma in cancer cells. Zhong Yao Cai 2008; 31: 1207-1211.
Opublikowano: 2013-10-31